종목토론카테고리
게시판버튼
게시글 제목
“새해 코로나 백신?치료제 우리가 책임진다" 15개 제약·바이오 기업 개발 경쟁 가속게시글 내용
코로나
19 바이러스와의 전쟁은 새해에도 현재 진행형이다. 셀트리온이 항체치료제로 빠르면 이달 중 국산 첫 코로나
19 치료제 허가를 받을 것으로 예상되는 가운데 다른
14개 제약 바이오 기업들도 뒤질세라 백신과 치료제 개발에 속도를 내고 있다. 코로나 치료제에 이어 백신도 연내 국산 약물 개발 가능성이 점쳐지고 있다. 지난해
12월부터 접종을 시작한 화이자 백신을 비롯해 해외 백신과는 1년간의 격차가 있지만 국내 제약?바이오 기업과 해외 기업간 기존 격차를 감안할 때 선전하고 있다는 평가도 있다.
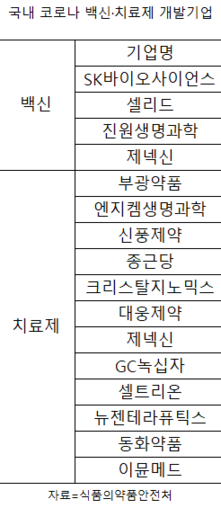
1일 식품의약품안전처에 따르면 지난해 27일 기준 국내서 코로나 19 백신과 치료제 개발을 위해 임상시험을 진행 중인 한국 제약·바이오기업은 모두 15곳으로 집계됐다.
코로나 19 백신 임상시험을 진행 중인 기업은 SK바이오사이언스, 셀리드, 진원생명과학(011000), 제넥신(095700)등 총 4곳이다. 코로나 19 치료제는 부광약품(003000), 엔지켐생명과학(183490), 신풍제약(019170), 종근당(185750), 크리스탈지노믹스, 대웅제약(069620), 제넥신, GC 녹십자(006280), 셀트리온(068270), 뉴젠테라퓨틱스, 동화약품(000020), 이뮨메드 등 12곳이다. 제넥신이 국내 기업으로는 유일하게 코로나 19 백신과 치료제 모두를 개발하기 위한 임상시험을 진행 중이다.
임상시험은 1~3상으로 구성된다. 1상은 통상 1년 내, 2상은 1~2년, 3상은 최대 5년이 걸리는 것으로 전해진다. 일부는 1, 2상과 2, 3상을 함께 승인 받아 진행하는 사례도 있다.
국내 기업들이 개발 중인 코로나 19 백신은 대부분 임상 1상, 1·2상 등 초기 단계에 머물고 있다. 미국 화이자, 모더나, 얀센(존슨앤드존슨 자회사)을 비롯 개발 경쟁에서 선두에 선 글로벌 제약사들이 임상 3상을 진행 중이거나 끝낸 것을 고려하면 속도면에서 뒤처지고 있다는 평가다.
코로나 19 치료제 개발 속도는 백신과 비교하면 크게 뒤지지 않는 편이다. 서정진 셀트리온 회장은 지난 11월 조선비즈와 한국보건산업진흥원이 주최한 ‘ 2020 헬스케어이노베이션 포럼’에서 코로나 19 항체치료제 개발 과정을 설명하며 "미국 것은 우리보다 한 달 반 정도 빠르다"며 "유럽은 (셀트리온 보다) 두 달 뒤에 있다"고 했다. 이어 "한 달반 뒤에는 미국이 하는 절차를 밟아 나갈 것"이라고 덧붙였다. 미국 일라이릴리, 리제네론은 코로나 19 항체치료제 임상 3상 시험을 진행 중이다.
실제 셀트리온은 국내서 코로나 19 치료제를 개발 중인 기업 중 상용화 가능성이 가장 큰 업체로 주목받고 있다. 지난달 29일 임상 2상 결과를 토대로 조건부 허가심사를 신청했다.
조건부 허가심사는 1~3상까지 단계를 거쳐야 하는 기본 품목허가 심사 절차와 달리 1~2상 임상까지 결과로 허가를 내주는 제도다. 치료제가 없는 질환에 활용하며 안전성 평가를 위해 임상 3상을 진행한 결과를 허가 이후 제출토록 한다.
김상봉 식약처 바이오생약국장은 지난달 29일 브리핑에서 "(셀트리온의 조건부 허가 신청은)세계적으로 개발 경쟁 중인 코로나 19 항체치료제 중 릴리, 리제네론에 이어 세 번째로 허가당국에 사용 승인 신청을 한 것"이라고 설명했다. 식약처는 기존 심사기간 180일을 최대한 단축해 40일 이내 심사를 처리하는 것을 목표로 하고 있다. 이르면 이달 중 심사 결과가 나올 수도 있는 것이다.
셀트리온의 항체치료제는 국내에서 유일하게 허가를 받은 미국 길리어드의 렘데시비르와 경쟁을 해야한다.
국내 개발 코로나 19 치료제 가운데 임상시험과 별개로 특정환자에게 가장 많이 투여된 것은 GC녹십자가 개발 중인 혈장치료제다. 지난 10월 19일 칠곡경북대병원을 시작으로, 12월 31일까지 식약처로부터 총 28건의 치료목적사용 승인을 받았다. 이는 국내 코로나 19 개발 기업 중 최다다. 치료목적사용 승인은 치료제가 없는 질환을 앓는 환자가 위급할 경우 임상시험을 진행 중인 의약품을 사용할 수 있게 하는 제도다. 치료목적사용 승인 건수가 많다는 것은 그만큼 의료현장에서 안전성과 효능을 인정받은 결과로 풀이된다. GC녹십자 역시 올해 1분기 중 조건부 허가 신청을 계획 중이다.
대웅제약과 종근당도 올 1분기 코로나 19 치료제의 조건부 허가 신청을 할 것으로 알려졌다. 대웅제약은 만성췌장염 치료제 호이스타정을 경증 코로나 19 환자에 투여하는 임상 2상을 진행했고, 이를 근거로 조건부 허가를 신청할 예정이다. 호이스타정은 개발에 성공하면 최초의 먹는 코로나 19 치료제로 주목을 끌 것으로 기대된다. 종근당도 급성췌장염 치료제 나파벨탄을 코로나 19 치료제로 개발 중이다. 러시아에서 진행한 임상 2상 중간결과에서 유의미한 결과를 얻어 이를 바탕으로 조건부 허가 신청 절차를 밟을 계획이다.
코로나 19 백신과 치료제 개발에 속도를 내는 기업들과 달리, 더딘 쪽도 있다. 최근 들어 국내서 하루 1000명 안팎의 코로나 19 신규 확진자가 나오고 있기는 하지만, 임상시험에 참가하는 환자 모집이 쉽지 않다고 중소제약 업계는 입을 모은다. 일각에선 정부가 일부 기업의 임상 환자 모집을 밀어 주고 있는 게 아니냐는 볼멘 소리도 나온다.
1일 식품의약품안전처에 따르면 지난해 27일 기준 국내서 코로나 19 백신과 치료제 개발을 위해 임상시험을 진행 중인 한국 제약·바이오기업은 모두 15곳으로 집계됐다.
코로나 19 백신 임상시험을 진행 중인 기업은 SK바이오사이언스, 셀리드, 진원생명과학(011000), 제넥신(095700)등 총 4곳이다. 코로나 19 치료제는 부광약품(003000), 엔지켐생명과학(183490), 신풍제약(019170), 종근당(185750), 크리스탈지노믹스, 대웅제약(069620), 제넥신, GC 녹십자(006280), 셀트리온(068270), 뉴젠테라퓨틱스, 동화약품(000020), 이뮨메드 등 12곳이다. 제넥신이 국내 기업으로는 유일하게 코로나 19 백신과 치료제 모두를 개발하기 위한 임상시험을 진행 중이다.

임상시험은 1~3상으로 구성된다. 1상은 통상 1년 내, 2상은 1~2년, 3상은 최대 5년이 걸리는 것으로 전해진다. 일부는 1, 2상과 2, 3상을 함께 승인 받아 진행하는 사례도 있다.
국내 기업들이 개발 중인 코로나 19 백신은 대부분 임상 1상, 1·2상 등 초기 단계에 머물고 있다. 미국 화이자, 모더나, 얀센(존슨앤드존슨 자회사)을 비롯 개발 경쟁에서 선두에 선 글로벌 제약사들이 임상 3상을 진행 중이거나 끝낸 것을 고려하면 속도면에서 뒤처지고 있다는 평가다.
코로나 19 치료제 개발 속도는 백신과 비교하면 크게 뒤지지 않는 편이다. 서정진 셀트리온 회장은 지난 11월 조선비즈와 한국보건산업진흥원이 주최한 ‘ 2020 헬스케어이노베이션 포럼’에서 코로나 19 항체치료제 개발 과정을 설명하며 "미국 것은 우리보다 한 달 반 정도 빠르다"며 "유럽은 (셀트리온 보다) 두 달 뒤에 있다"고 했다. 이어 "한 달반 뒤에는 미국이 하는 절차를 밟아 나갈 것"이라고 덧붙였다. 미국 일라이릴리, 리제네론은 코로나 19 항체치료제 임상 3상 시험을 진행 중이다.
실제 셀트리온은 국내서 코로나 19 치료제를 개발 중인 기업 중 상용화 가능성이 가장 큰 업체로 주목받고 있다. 지난달 29일 임상 2상 결과를 토대로 조건부 허가심사를 신청했다.
조건부 허가심사는 1~3상까지 단계를 거쳐야 하는 기본 품목허가 심사 절차와 달리 1~2상 임상까지 결과로 허가를 내주는 제도다. 치료제가 없는 질환에 활용하며 안전성 평가를 위해 임상 3상을 진행한 결과를 허가 이후 제출토록 한다.
김상봉 식약처 바이오생약국장은 지난달 29일 브리핑에서 "(셀트리온의 조건부 허가 신청은)세계적으로 개발 경쟁 중인 코로나 19 항체치료제 중 릴리, 리제네론에 이어 세 번째로 허가당국에 사용 승인 신청을 한 것"이라고 설명했다. 식약처는 기존 심사기간 180일을 최대한 단축해 40일 이내 심사를 처리하는 것을 목표로 하고 있다. 이르면 이달 중 심사 결과가 나올 수도 있는 것이다.
셀트리온의 항체치료제는 국내에서 유일하게 허가를 받은 미국 길리어드의 렘데시비르와 경쟁을 해야한다.
국내 개발 코로나 19 치료제 가운데 임상시험과 별개로 특정환자에게 가장 많이 투여된 것은 GC녹십자가 개발 중인 혈장치료제다. 지난 10월 19일 칠곡경북대병원을 시작으로, 12월 31일까지 식약처로부터 총 28건의 치료목적사용 승인을 받았다. 이는 국내 코로나 19 개발 기업 중 최다다. 치료목적사용 승인은 치료제가 없는 질환을 앓는 환자가 위급할 경우 임상시험을 진행 중인 의약품을 사용할 수 있게 하는 제도다. 치료목적사용 승인 건수가 많다는 것은 그만큼 의료현장에서 안전성과 효능을 인정받은 결과로 풀이된다. GC녹십자 역시 올해 1분기 중 조건부 허가 신청을 계획 중이다.
대웅제약과 종근당도 올 1분기 코로나 19 치료제의 조건부 허가 신청을 할 것으로 알려졌다. 대웅제약은 만성췌장염 치료제 호이스타정을 경증 코로나 19 환자에 투여하는 임상 2상을 진행했고, 이를 근거로 조건부 허가를 신청할 예정이다. 호이스타정은 개발에 성공하면 최초의 먹는 코로나 19 치료제로 주목을 끌 것으로 기대된다. 종근당도 급성췌장염 치료제 나파벨탄을 코로나 19 치료제로 개발 중이다. 러시아에서 진행한 임상 2상 중간결과에서 유의미한 결과를 얻어 이를 바탕으로 조건부 허가 신청 절차를 밟을 계획이다.
코로나 19 백신과 치료제 개발에 속도를 내는 기업들과 달리, 더딘 쪽도 있다. 최근 들어 국내서 하루 1000명 안팎의 코로나 19 신규 확진자가 나오고 있기는 하지만, 임상시험에 참가하는 환자 모집이 쉽지 않다고 중소제약 업계는 입을 모은다. 일각에선 정부가 일부 기업의 임상 환자 모집을 밀어 주고 있는 게 아니냐는 볼멘 소리도 나온다.
게시글 찬성/반대
- 0추천
- 0반대
내 아이디와 비밀번호가 유출되었다? 자세히보기 →
운영배심원의견
운영배심원의견이란
운영배심원 의견이란?
게시판 활동 내용에 따라 매월 새롭게 선정되는
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.
운영배심원(10인 이하)이 의견을 행사할 수 있습니다.
운영배심원 4인이 글 내리기에 의견을 행사하게 되면
해당 글의 추천수와 반대수를 비교하여 반대수가
추천수를 넘어서는 경우에는 해당 글이 블라인드 처리
됩니다.






댓글목록